研发进展 | 创新药马来酸阿伐曲泊帕治疗成人慢性ITP中国Ⅲ期研究结果正式见刊!

马来酸阿伐曲泊帕是复星医药引进的小分子创新药、新一代血小板生成素受体激动剂(TPO-RA),于2019年5月获得国家药品监督管理局(NMPA)授予优先审评资格,2020年4月被批准用于择期行诊断性操作或者手术的慢性肝病(CLD)相关血小板减少症的成年患者治疗,其用于治疗对既往治疗反应不佳的成人慢性免疫性血小板减少症(ITP)的适应症目前已在美国和欧洲获批。2023年9月11日,马来酸阿伐曲泊帕治疗成人慢性ITP的中国境内Ⅲ期主要研究结果正式发表于国际SCI期刊Research and Practice in Thrombosis and Haemostasis(IF=4.6)1。

来源:期刊发表页面
研究设计
研究由3个阶段构成:筛选期(4周)、核心治疗期(6周)和扩展治疗期(20周)。确诊为慢性原发ITP(持续时间≥12个月)和血小板计数均值<30×109/L的18-80岁受试者以2:1的比例随机接受马来酸阿伐曲泊帕(起始剂量20 mg)或安慰剂治疗6周。完成6周核心治疗期后,合格的受试者将进入为期20周的马来酸阿伐曲泊帕开放标签扩展治疗期。主要研究终点是在没有补救治疗情况下,核心治疗期第6周时血小板计数≥50×109/L的产生血小板反应的受试者比例。
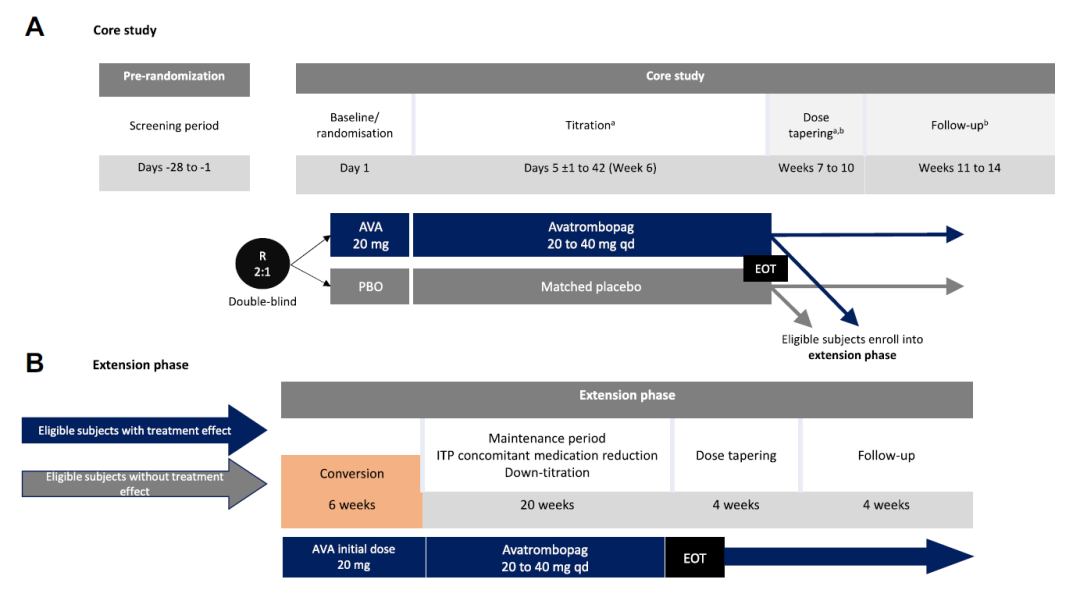
图1 核心治疗期(A)和扩展治疗期(B)的研究设计
AVA, 阿伐曲泊帕; EOT, 治疗结束; ITP, 免疫性血小板减少症; PBO, 安慰剂; qd, 每天一次
研究结果
共74例受试者在核心治疗期随机接受马来酸阿伐曲泊帕(n=48)或安慰剂(n=26)治疗。基于全分析集的分析结果显示,治疗6周后,马来酸阿伐曲泊帕组的受试者血小板反应率为77.1% (95% CI:62.7%, 88.0%),安慰剂组为7.7% (95% CI:1.0%, 25.1%),两组反应率差值为69.4% (95% CI:56.2%, 86.3%)。研究达到主要研究终点,结果支持马来酸阿伐曲泊帕优于安慰剂。在所有预先定义的亚组(脾切除术状态、基线血小板计数、基线ITP伴随用药)和事后亚组(既往TPO-RA用药)分析结果与主要研究结果一致(图2)。整个研究期间接受马来酸阿伐曲泊帕治疗受试者的平均累积血小板反应时间为15.3周。
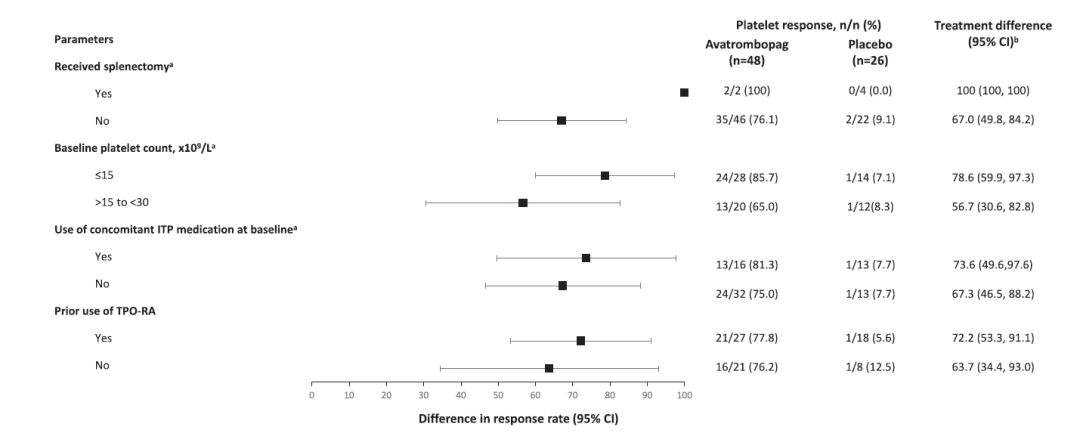
图2 关于治疗第6周时有血小板反应的受试者比例的亚组分析
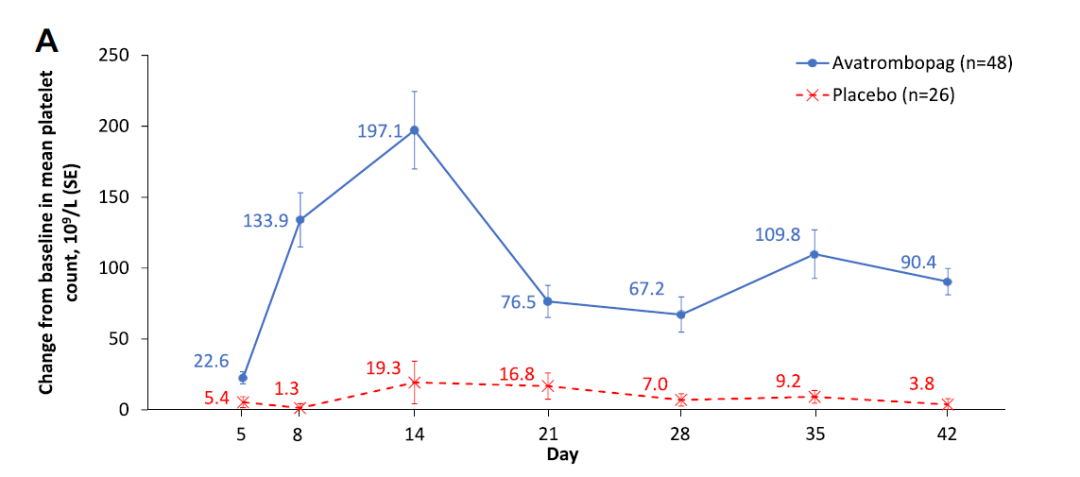
图3 在6周核心治疗期中,两组血小板计数较基线水平的平均(标准偏差)变化
在核心治疗期,马来酸阿伐曲泊帕组和安慰剂组治疗期间不良事件(TEAE)发生率分别为85.4%和76.9%,两组分别有2
(4.2%) 和 5 (19.2%)例患者发生与治疗药物无关的3级及以上不良反应事件。核心治疗阶段暴露调整后阿伐曲泊帕组和安慰剂组治疗相关性不良事件发生率分别为0.021/患者日,0.009/患者日。
研究结论
在中国慢性ITP成人患者中,马来酸阿伐曲泊帕治疗6周后血小板计数达到≥50 × 109的患者高达77.1%,显著优于安慰剂。马来酸阿伐曲泊帕总体耐受性良好,在核心治疗期没有因治疗相关的TEAE而中断治疗,也没有治疗相关的严重不良事件报道。
期刊介绍:

2022年影响因子:4.6 中科院SCI(2022年12月升级版)2区期刊
Research and Practice in Thrombosis and Haemostasis是国际血栓与止血学会(the International Society on Thrombosis and Haemostasis, ISTH)的官方期刊,主要刊登血栓形成、止血、血管疾病及相关领域的基础、转化、临床和人口/公共卫生研究论文,同时也刊登包括针对新型护理和定性研究在内的质量、结果、传播和实施科学相关的论文。
审批号:NP-MA-20230915-CN-AVA-00006
参考文献:
-
1. Heng Mei, et al. Avatrombopag for adult chronic primary immune thrombocytopenia: a randomized phase 3 trial in China. Res Pract Thromb Haemost. 2023;7:e102158.






