全球研发 | 芦沃美替尼(FCN-159)治疗儿童NF1更新数据于ASCO 2025公布



2025年5月22日,美国临床肿瘤学会(ASCO)年会公布了入选研究摘要。由复星医药自主研发的芦沃美替尼片(FCN-159)治疗儿童I型神经纤维瘤病相关丛状神经纤维瘤(NF1相关PN)的2期临床研究更新数据入选1。
芦沃美替尼片是一款高选择性MEK1/2抑制剂,其双适应症(朗格汉斯细胞组织细胞增生症和组织细胞肿瘤、I型神经纤维瘤病相关丛状神经纤维瘤)在获CDE多次突破性治疗和优先审评认定后,已于5月29日获批上市。
基于该研究在2023年及2024年ASCO年会已公布的1/2期研究数据,本次数据更新了最新随访的疗效和安全性数据,展示了芦沃美替尼积极的临床获益和良好的安全性,将为芦沃美替尼的科学治疗再添力证。

聚焦 NF1 儿童困境,填补治疗空白
I 型神经纤维瘤病(NF1)是一种常染色体显性遗传性肿瘤性疾病,常累及多系统。约 30%-50% 的患者伴发丛状神经纤维瘤(PN),可导致毁容、疼痛、身体功能障碍等严重问题并显著影响患者生活质量。PN 患者大多在幼年时期起病,且在生长发育关键的儿童期疾病进展更为迅速,因此儿童 NF1-PN 的治疗需求尤为迫切2。
目前手术虽为NF1相关PN的主要治疗手段,但因为瘤体起源于神经,约只有15% 的患者肿瘤可完全切除,43%的患者术后会出现PN复发3。不可切除或术后复发的 PN 患者治疗选择极为有限,尤其是对于2 岁的中国儿童患者,在芦沃美替尼获批前无药物可用。
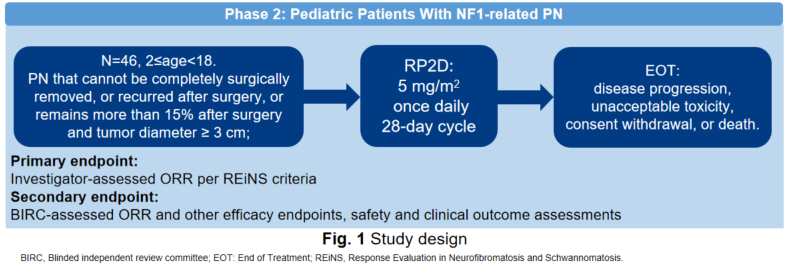
本研究为一项多中心,开放标签2期临床试验。其主要目的是评估芦沃美替尼片(FCN-159)治疗儿童I型神经纤维瘤病相关丛状神经纤维瘤(NF1相关PN)的有效性及安全性。主要终点为研究者评估的客观缓解率(ORR),关键次要终点为盲态独立评审委员会(BIRC)评估的ORR。
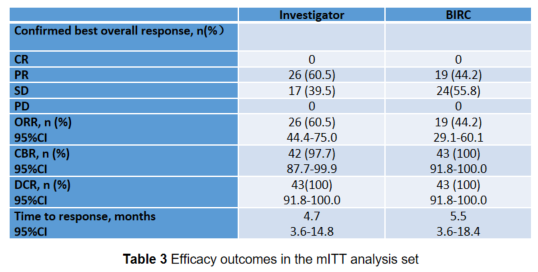
芦沃美替尼起效迅速且疗效显著,ORR达60.5%,中位起效时间为4.7个月
截至2024年9月23日,本项多中心,开放标签2期临床研究纳入46例2-18岁(不含)NF1相关PN儿童患者接受芦沃美替尼(5 mg/m2,每日一次)治疗。中位随访时间为25.1个月。
在43 例可评估患者中,研究者评估且确认的客观缓解率(ORR)达60.5%(95% CI:44.4-75.0),26 例达到部分缓解(PR),17 例疾病稳定(SD),无患者疾病进展。中位缓解持续时间(DOR)和中位无进展生存期(PFS)未达到。
在43例可评估患者中,BIRC评估且确认的 ORR 为44.2%(95% CI:29.1-60.1),19 例达到PR,24 例达到SD,无患者疾病进展。
研究者评估的中位起效时间为4.7个月,BIRC评估的中位起效时间位5.5个月。
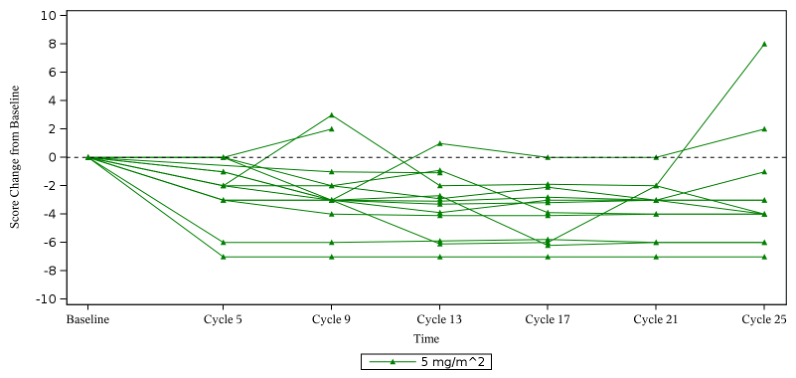
基线NRS≥2 分患者中,92.9%疼痛明显改善
在 14 例可评估疼痛的患者中(即基线总体肿瘤疼痛评分≥2且至少有一次基线后评估的患者),与基线相比,中位最大疼痛降低分数的变化为-3.5分。13例(92.9%)患者的疼痛评分至少降低2分,达到了临床意义的改善。11例(78.6%)患者的疼痛评分为0,即疼痛完全消失。
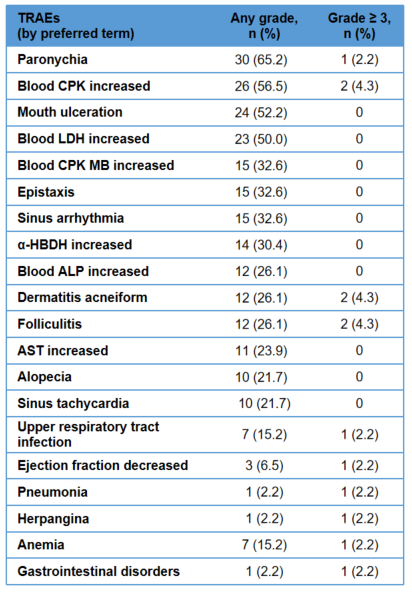
安全性良好,不良事件多为1-2级且可控,未出现新的安全性信号
与研究药物有关的不良事件(TRAEs)发生率为 97.8%,以 1-2 级为主,≥3 级 TRAEs 仅占21.7%,常见不良事件主要包括甲沟炎(65.2%)、血肌酸磷酸激酶(CPK)升高(56.5%)、口腔溃疡(52.2%)和血乳酸脱氢酶升高(50%),均为 MEK 抑制剂类药物常见可控性反应。
腹痛、腹泻、恶心和呕吐的发生率在 2.2% 至 19.6% 之间,且均未达 3 级。仅 2 例(4.3%)患者出现与研究药物有关的严重不良事件(痤疮样皮炎和感染性肺炎)。13例(28.3%)患者出现导致暂停用药的TRAE,无TRAE导致剂量降低、永久停药或死亡。患者依从性达到100%。
芦沃美替尼的安全性良好,不良事件经过对症治疗和暂停用药后可有效管理。在儿童及青少年中耐受性良好。
代谢稳定、高选择性、低毒性的特点,为中国 NF1 患儿带来临床获益
作为首个国产MEK抑制剂,芦沃美替尼在结构上通过协同设计,实现了代谢稳定、高选择性和低毒性,以及半衰期延长的优势。药代动力学特征支持药物每日给药1次,不受餐食影响并具有更少的合并用药影响,均带来更好的依从性,适合儿童长期用药。芦沃美替尼不仅以高选择性机制突破了传统治疗的局限性,更通过显著的肿瘤缓解率与疼痛改善数据,将为 NF1 患儿带来积极的临床获益。
此外,芦沃美替尼片用于治疗成人Ⅰ型神经纤维瘤病于中国境内处于Ⅲ期临床试验阶段,该药品用于低级别脑胶质瘤、颅外动静脉畸形、儿童朗格汉斯细胞组织细胞增生症的治疗于中国境内均处于Ⅱ期临床试验阶段,其中,该药品用于无法手术或术后残留/复发的NF1相关的丛状神经纤维瘤成人患者、儿童朗格汉斯组织细胞增生症两项适应症均已被国家药监局药品审评中心纳入突破性治疗药物程序。复星医药将持续推进芦沃美替尼片在其它适应症的开发,为更多患者带来福音。
*本材料为专业医学资料,仅供医疗卫生专业人士参考,具体诊疗信息请遵医嘱。
参考文献:
1. JinHu Wang et al. JCO 43, 10044-10044(2025).
2. 中国罕见病联盟Ⅰ型神经纤维瘤病多学科诊疗协作组. [J].罕见病研究, 2023,2(2):210-230.
3. Fisher MJ, et al. Neuro Oncol. 2022;24(11):1827-1844










